| Auteur | Message |
|---|---|
|
Administrateur
|
Précédemment, nous avons vu que la liaison entre deux atomes peut être non‑polarisée, polarisée ou même ionisée. Mais la plupart des molécules organiques, contiennent beaucoup d’atomes, pas seulement deux. Avec plusieurs atomes, les différences de charges partielles en divers endroits de la molécule, provoquent des pressions qui peuvent tordre la molécule, des parties de la molécule tendant à en repousser d’autres parties. Les molécules où les chargent sont équilibrées, sont symétriques dans l’espace, par exemple une pyramide régulière, les autres ont des formes asymétriques avec des parties se distinguant des autres.
Par exemple le C0₂ (dioxyde de carbone) est une molécule symétrique non‑polarisée, tandis que le H₂O (l’eau), est une molécule polarisée, non‑symétrique, elle forme un coude, elle est « tordue ». Pour aller plus loin, il faudrait aborder les schémas de Lewis, je penses, mais une petite introduction intuitive ne fera pas de mal. La vidéo ci‑dessous donne des exemples en images, sans trop formaliser. Polar and non polar covalent molecules — SciencePost — 2013 |
|
Administrateur
|
Cette partie fait suite aux deux précédents messages, sur la polarisation des liaisons, c’est à dire la probabilité de présence des électrons autour d’un atome ou d’un autre, et sur la forme des molécules.
En chimie, on se soucie surtout des électrons, car bien qu’ayant un effet, par exemple dans la distance entre deux atomes liés dans une molécule, les noyaux peuvent être ignorés. Les électrons ont une probabilité de présence en un point, un niveau d’énergie et un spin. Le mot “ spin ” renvoi une mauvaise image de la réalité physique, c’est seulement qu’il a une raison historique, et que ce nom est resté. La probabilité de présence en un point, n’est jamais nulle, même à très longue distance, mais ce n’est que théorique, car elle est alors tellement faible, qu’on peut l’ignorer en pratique. Le spin est peu important en chimie en général, il sert surtout en particulier, à déterminer la répartition des électrons d’un atome, comme expliqué plus loin. La délimitation de la région de l’espace où un électron a une probabilité de présence d’au moins 90%, est nommée l’orbitale de l’électron (une orbitale peut être partagée par deux électrons, comme nous le verrons plus loin). Cette région de l’espace est un volume en trois dimensions. Les orbitales de plusieurs électrons peuvent se combiner (combiner, ce n’est pas une simple addition, ou pas toujours … on parle par exemple d’hybridation, qui sera peut‑être abordée plus tard), pour former une orbitale plus complexe. La forme et les dimensions de cette orbitale, sont la forme et les dimensions de l’atome ou de la molécule auxquels on s’intéresse (les orbitales des électrons, sont la clé). Les niveaux d’énergie sont numérotés de 1 à 4. On les appel des couches électroniques, et le numéro est appelé le nombre quantique principal de l’orbitale de cette couche. Chaque atome peut avoir une ou plusieurs couches électroniques. Les couches électroniques, sont elles‑mêmes composées de sous‑couches électroniques, elles sont en nombre fini, et sont nommées s, p, d et f. Chaque sous‑couche peut contenir une ou plusieurs orbitales. Chaque orbitale peut contenir au plus deux électrons, et ces deux électrons ne peuvent pas avoir le même spin. Ceci est pour simplifier, il y a des règles supplémentaires données plus loin (et elles‑mêmes sont simplifiées, en ignorant les atomes plus lourds que le fer). Édit : l’énergie d’un électron se mesure en électron‑volt, noté eV, qui est une unité très faible, à l’échelle des particules que sont les électrons En Anglais, on dit “ shell ” et “ subshell ” pour « couche » et « sous‑couche ». La répartition des électrons dans les différentes couches, s’appelle la configuration électronique. Chaque sous‑couche a une forme caractéristique, une forme pour chacune des lettre s, p, d et f. La forme est la même quelque soit la couche à laquelle elles appartiennent, seulement leur échelle change : d’autant plus grande que le numéro de la couche est élevé. Ces formes caractéristiques, sont données plus loin. Les noms s, p, d et f, viennent de spherical, principal, diffuse et fundamental, en français, sphérique, principale, diffuse et fondamentale (fondamentale, au sens des séries harmoniques, je crois, mais ça me semble étrange aussi). Ces noms ne sont pas représentatifs de la forme des orbitales, excepté pour la sous‑couche s, qui a effectivement une forme sphérique. Les électrons peuvent avoir un seul parmi deux spin, représentés par une flèche qui monte et une flèche qui descend. Cette flèche a parfois sa tête dessinée seulement d’un côté, et ce n’est qu’une question de style.
Je préfère personnellement la notion utilisant une flèche avec une tête complète, car je trouve que le symbole↿se confond trop facilement avec le chiffre 1. Chaque couche ne peut pas contenir toutes les sous‑couches possibles. Chaque couche peut contenir un nombre de sous‑couches égale à son numéro, et ces sous‑couches sont attribuées dans l’ordre s, p, d, f :
Mnémotechnique : notez que le compte de sous‑couches est égal au nombre quantique principal. Les couches sont parfois aussi nommées en commençant par K au lieu de 1 : K, L, M, N au lieu de 1, 2, 3, 4. Dans la liste ci‑dessous, retenez surtout le nombre d’orbitales dans chaque sous‑couche. Les formes seront données en images plus tard.
Mnémotechnique : notez que le compte d’orbitales augmente de 2 à chaque fois. Une notation de la forme Nx où N est un chiffre et x une lettre, représente une sous‑couche. Une sous‑couche, se note en donnant le numéro de la couche puis la lettre représentant la sous‑couche. Par exemple 1s pour la sous‑souche s de la première couche, 2p, pour la sous‑couche p de la deuxième couche. C’est aussi une manière de désigner les orbitales. Par exemple 2p, représente l’ensemble des trois orbitales de la sous‑couche 2p. Les règles présentées ici, sont simplifiées, elles ne sont valable que j’usqu’à 26 électrons, c’est à dire jusqu’au fer. Plus loin, sont indiqués des liens donnant les règles complètes. Notez que au delà, les règles plus complètes sont aussi sujettes à des exceptions, par exemple avec le cuivre. Pour la chimie organique, aller jusqu’au fer est souvent suffisant. Autre limitation, la procédure de répartition des électrons décrite ci‑dessous, ne vaut que pour le niveau d’énergie le plus bas d’un atome, nommé état fondamental, ou “ ground state ” en Anglais, de cet atome, mais cet état est aussi le plus courant pour les atomes. L’autre état, l’état excité, n’est que transitoire, même s’il est important pendant les réactions physicochimiques. Les électrons se placent en commençant par les sous‑couches de moindre énergie, pour passer ensuite aux sous‑couches d’énergie plus élevée. Cet ordre des sous‑couches est : 1s, 2s, 2p, 3s, 3p, 4s, 3d, 3p (on peut aller plus loin, mais ce message n’en parlera pas). C’est la règle de Klechkowski (qui n’est ici donnée que partiellement). Les orbitales d’une même sous‑couche, sont toutes au même niveau d’énergie. Par exemple les trois orbitales de la sous‑couche 2p, sont toutes au même niveau d’énergie. Dans une sous‑couche, les électrons essaient d’abord d’occuper toutes les orbitales, et seulement s’il n’y a plus d’orbitales libres, il vont occuper les orbitales à deux ; c’est la règle de Hund. Une orbitale, peut contenir deux électrons au plus, et s’il y en a deux, ces deux électrons doivent être de spin opposés, en conséquence du principe d’exclusion de Pauli. Deux électrons de même spin ne peuvent pas occuper la même orbitale, si on veut en mettre deux dans la même orbitale, il faut inverser le spin de l’un. Ce sont les électrons de la dernière couche (qui peut contenir plusieurs sous‑couches) et de la dernière sous‑couche non‑pleine, qui sont les plus importants pour la chimie, car c’est avec eux que se font les liaisons. Ces électrons sont nommés électrons de valence. La liaison chimique éventuellement formée par deux électrons chacun venant d’un atome et mis en commun, s’appel la liaison covalente. Pour nommer les couches et sous‑couches d’un atome, on utilise des termes de la forme Nsⁿpⁿdⁿfⁿ, on commence par donner le numéro de la couche, puis on liste les sous‑couche en indiquant leur lettre, en ajoutant en exposant de chaque sous‑couche, le nombre d’électrons qu’elle contient. Les couches et sous‑couches vides, ne sont pas écrites. On fait de même pour toutes les couches, dans l’ordre. Par exemple : 1s²2s³, qui signifie qu’il y a deux électrons dans la sous‑couche s de la première couche, et trois électrons dans la sous‑couche s de la deuxième couche. On ne peut pas écrire n’importe quoi comme ça, car le placement des électrons doit correspondre aux règles décrites plus haut. Certains tableaux de classification des éléments, donne la répartition des électrons dans les couches, avec la notation décrite plus haut. On peut déterminer cette répartition en connaissant le nombre d’électrons seulement, et en appliquant les règles données plus haut. Vous pouvez en faire un exercice en vérifiant sur une tel tableau de classification, pour vous corriger. Notez que les tableaux n’indiquent pas tous la configuration électronique et n’oubliez pas que les règles données ici, ne valent que pour les atomes à quatre couches au plus. La raison pour laquelle les électrons se placent ainsi, sera présentée dans une vidéo casse‑tête un peu plus tard. Il n’est pas nécessaire de le comprendre, ce pourquoi n’est pas nécessaire pour la chimie, il concerne plus la physique. Quantum‑mechanical orbitals and electron configurations — Chemistry with Mrs. K — 2015 Ils sont ingrats ces élèves, à la fin tout le monde se barre alors qu’elle n’a même pas fini de parler !  En plus de la vidéo ci‑dessus, les personnes intéressées pourront aussi lire ce court document, sur la règle de Klechkowski, le principe d’exclusion de Pauli et la règle de Hund : Règles (lct.jussieu.fr) [PDF]. Ou encore : Remplissage des couches électroniques (physique.chimie.29.free.fr). Ou La configuration électronique (annecurkpucheu.fr). |
|
Administrateur
|
Hibou a écrit : […] Voici : 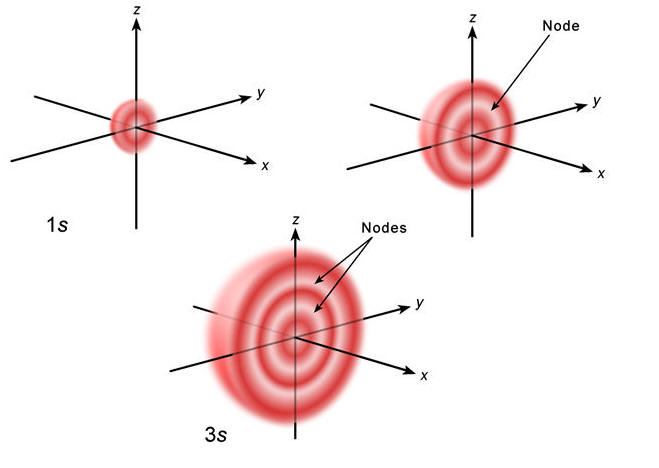 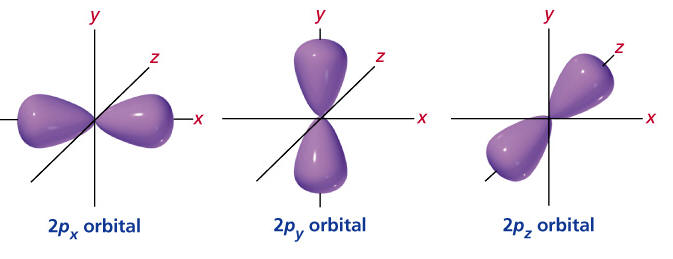 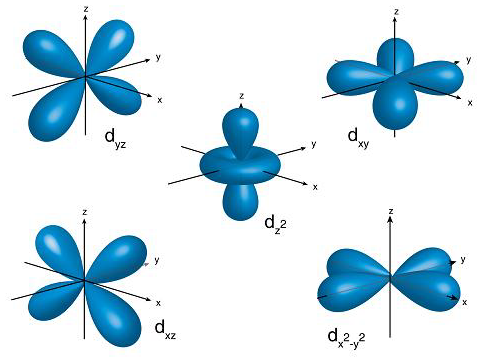 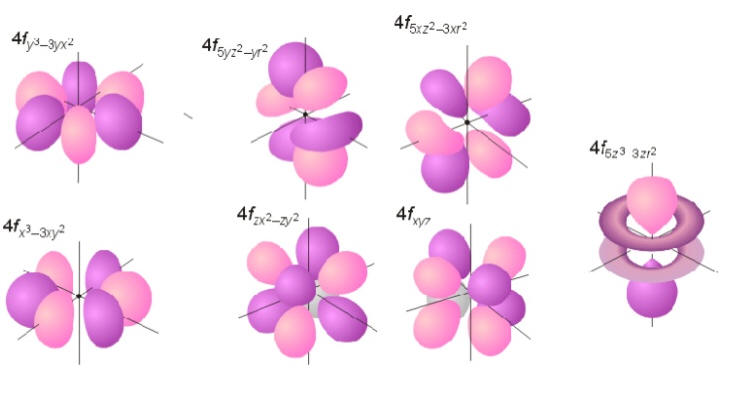 Images : kentchemistry.com. Ou plus compliqué : 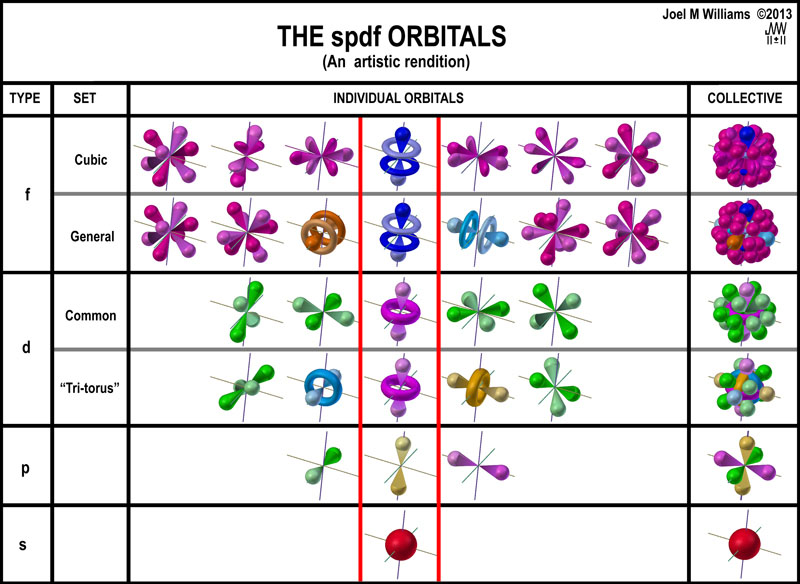 Image : pages.swcp.com/~jmw-mcw. |
|
Administrateur
|
Hibou a écrit : […] Les curieux(ses) pourront voir ce PDF, qui montre comment l’attraction / répulsion entre deux atomes d’hydrogène par exemple, varie avec la distance entre les deux atomes : La liaison chimique, formation des molécules (cinam.univ-mrs.fr) [PDF]. |
|
Administrateur
|
Hibou a écrit : […] Voici, en deux vidéos qui l’expliquent partiellement, et en oubliant pas qu’il n’est pas nécessaire (mais pas inutile) de comprendre, comme c’est en partie plus de la physique quantique que de la chimie : Electron orbitals — Jonathan Bergmann et Aaron Sams — 2010 Electron energy and orbitals — Spoon Feed Me — 2014 |
|
Administrateur
|
Hibou a écrit : […] L’énergie d’un électron se mesure en électron‑volt, noté eV, qui est une unité très faible, à l’échelle des particules que sont les électrons. Attention :
Les électrons peuvent passer d’une couche à une autre, ou d’un niveau d’énergie à un autre (c’est la même chose) en absorbant ou en émettant un photon d’énergie correspondante à la différence d’énergie entre la couche de départ et la couche d’arrivée. Note : il y a une relation directe entre l’énergie d’un photon et sa fréquence. Cette absorption ou émission d’un photon, est mise à profit dans certaines méthodes d’analyse. Un électron ne peut passer que d’une couche à une autre, jamais se trouver dans un néant entre deux couches, à moins que l’électron ne soit libre, lié à aucun atome. L’électron peut sauter plusieurs couches à la fois, en descendant ou en montant en énergie. Le spectre des photons pouvant être absorbés ou émis, est déterminé par l’ensemble des combinaisons de couche de départ et d’arrivée. Note : ceci s’applique aux électrons d’atomes isolés. C’est implicite, mais il faut le garder en vue, car les comportements des électrons des les liaisons entre atomes, sont plus variés. La vidéo plus loin explique tout ceci en images et en Anglais. Questions restant en suspend jusqu’ici :
D’après la vidéo ci‑dessous, l’énergie d’un électron pour chaque couche (la lettre est le nom de la couche, le numéro est le nombre quantique principal, les deux étant synonymes) :
Mnémotechnique : notez que les différences sont 4, 2 et 1, à chaque fois divisées par deux. Comme le compte maximum d’électrons d’une couche est d’autant plus élevé que son nombre quantique principal est élevé, les couches de plus basses énergies sont celles pouvant contenir le moins d’électrons et celles de plus hautes énergies sont celles pouvant contenir le plus d’électrons. Donc encore, plus un atome a d’électrons, plus ces électrons ont d’énergie en moyenne ; l’énergie cumulée des électrons d’un atome, augmente plus vite que son compte d’électrons. Rappel : dans la vidéo, les cercles ne sont pas des orbites ; c’est une représentation conventionnelle pour les niveaux d’énergie. Atomic energy levels — We Are Showboat — 2013 Via Atomic energy levels (khanacademy.org). |
|
Administrateur
|
Le nombre maximum d’électrons dans une couche, est égale à 2n², où n est le nombre quantique principale. On trouve les valeurs suivantes, qui doivent être compatibles avec les règles données dans un précédent message, ce qui sera vérifié juste après :
Vérification … Nous avons ces niveaux d’organisation : couche ⟶ sous‑couche ⟶ orbitale ⟶ électron. Pour chaque couche, le nombre de sous‑couche est égale au nombre quantique principal :
Pour chaque sous‑couche, le nombre d’orbitale augmente de 2 par rapport à la précédente, en commençant avec une orbitale :
Chaque orbitale peut contenir au plus deux électrons (et ceux ci sont de spins opposés, mais ça n’a pas d’importance pour ce que nous vérifions maintenant). Combinons (avec une accumulation d’une ligne à l’autre, pour être plus concis) :
On retrouves bien les mêmes comptes. |
|
Administrateur
|
Les orbitales des électrons, sont une conséquence de l’équation de Schrödinger : Quantum mechanics and atomic orbitals (mikeblaber.org).
S’il existe un moyen de la comprendre pour les non‑physiciens, il faudra voir si elle peut être un outil pratique en chimie. |
|
Administrateur
|
Une présentation succincte de l’hybridation des orbitales s, p et d, les plus simples. Je crois que le compte l’ayant posté sur YouTube n’est pas l’auteur, alors pas possible de donner la référence exacte.
Hybrid orbital formation |
|
Administrateur
|
Les liaisons chimiques ne sont pas que des liaisons par paire d’électrons. Voici les grands types de liaisons chimiques connues, certaines étant faibles.
|
