| Auteur | Message |
|---|---|
|
Administrateur
|
Dans ce sujet, seront répertoriés des documentaires sur la chimie organique et la biologie moléculaire, accompagnées de résumés écrits, en évitant les vidéos de conférences en amphi, qui endorment en plus d’être typiquement peu audibles et de souvent montrer des rétroprojections illisibles car floues.
L’idée m’est venu en me disant que ce serait bien, si on pouvait fabriquer du lait synthétique, pour en faire des fromages qui gratinent en cuisine, comme je ne connais aucune bonne alternative végétale aux fromages et aux laits. Je me suis dit que je n’y connais rien, que je n’ai aucune idée de par où il faut commencer, ce qui ensuite m’a fait remarquer que la chimie organique et la biologie moléculaire, sont peu abordées sur le forum et même en général dans les articles grand‑public. La biologie, avec les logiques (les logiques, encore plus), me semble être parmi les sciences les moins considérées par le grand‑public et la pédagogie tout public. Peut‑être parce que les sciences spectacles — par le buzz ou par l’image — ont plus de succès, et que la biologie ne se donne pas en spectacle, ne fait pas le buzz, excepté quand il s’agit de mots magiques comme « ADN » et « OGM ». Même l’exobiologie semble avoir plus de succès que la biologie !  Comme la biologie est peu considérée, il sera difficile de trouver de bons documentaires qui ne donnent pas envie de dormir. Si vous en connaissez un, n’hésitez pas à vous inscrire sur le forum pour le proposer. En complément, sera ouvert un autre jour, un sujet sur les microorganismes, bactéries, levures, et virus, même si ces derniers ne sont pas des organismes. De même, avec un sujet sur les bases de la chimie en général, quoique ce sujet abordera aussi ces bases. Ce sujet suppose un minimum de familiarité élémentaires, disons niveau collège, même si les connaissances ont été oubliées, elles doivent être familières, avoir un air de déjà‑vu. — Édit du 2024-11-09 — Apprentis chimistes (ac-clermont.fr) [PDF], 28 Novembre 2018. Document pédagogique a écrit :
Chimique ne s’oppose pas à naturel. On opposera à naturel le terme artificiel. |
|
Administrateur
|
Même si elle n’est pas sous forme d’un documentaire, je relève celle‑ci, qui est lisible et audible, et parce qu’elle semble avoir aidé des étudiants en chimie organique. C’est long, environ quatre heures ! C’est aussi en Anglais, et je crois pouvoir prévenir dès maintenant que ce sera le cas de la plupart des vidéos de ce sujet.
Si vous êtes perdu(e)s, passez au trois messages suivants pour revenir plus tard à celui‑ci. Organic chemistry #1, introduction / basic overview — The Organic Chemistry Tutor — 2016 |
|
Administrateur
|
Définitions de quelques termes de la chimie organique, à commencer par le qualificatif « organique » lui‑même.
Le mot organique en chimie, n’a pas le même sens que le sens général du mot. Le mot en chimie, vient de l’époque où il était crut que certains composés ne pouvaient être produit que par les êtres vivants. Ils sont bien produits par ces derniers, mais ils peuvent aussi être synthétisés, comme découvert plus tard. En science, organique, se dit d’une molécule constituées entre autres d’atomes de carbone, liés à des atomes d’hydrogène. Ces molécules peuvent contenir d’autres éléments, principalement l’oxygène, l’azote, le chlore, mais pas seulement. La chimie organique, c’est la chimie des éléments composés comprenant du carbone lié à de l’hydrogène (voir définition précédente). Il y a autant de chimies organiques qu’il y a de molécules organiques, car chaque molécule organique a des propriétés chimiques et physiques qui lui sont propres, et il existe des milliers de composés organiques différents. La chimie organique est un sous‑ensemble de la chimie en générale, elle s’intéresse à la chimie qui est de fait à la base des métabolismes des formes de vies. Pourquoi le carbone ? Parce que de fait, le carbone se retrouve dans toutes les formes de vie sur Terre. Le carbone peut former quatre liaisons, et l’hydrogène, une seule. Dans une molécule organique, un carbone peut être lié à un autre carbone, en plus d’être lié à des hydrogènes (voir plus bas pour plus). Les molécules reposant ces liaisons, sont dites hydrocarbures. La liaison avec un carbone, peut utiliser une liaison simple, double ou triple, et ces trois types de liaisons, sont appelées liaisons linéaires. Quand une molécule organique n’a que des liaisons simples entre ses carbones et que les autres liaisons des carbones sont toutes occupées par des hydrogènes, alors on parle de molécule organique saturée ; comprendre « saturée en hydrogène ». Dans les autres cas, on dit que la molécule est insaturée. Un hydrocarbure est saturée si les liaisons carbone‑carbone sont toutes des liaisons simples (pas de liaisons doubles ou triples). Un carbone peut être lié à un autre carbone, lui‑même lié à un autre carbone, ainsi de suite, formant une chaîne. Le nom de la molécule ainsi formée, peut commencer par un préfixe indiquant le nombre de carbones dans la chaînes, par exemple hexane, pour six carbones. Quand les carbones ne forment pas une simple chaine, le nom peut être plus complexe, mais en faisant toujours apparaitre le nombre de carbones, comme par exemple isohexane quand un carbone est « décalé » en formant une branche, ou encore cyclohexane, quand six carbones sont liées en formant une boucle. Sa vidéo est la première d’une série de trois. Je poste et résume les deux suivantes dans les deux messages suivants. Organic chemistry: a brief overview — AdventuresInSci — 2012 |
|
Administrateur
|
Note : le mot Anglais “hydrocarbon”, se traduit en français plutôt par « hydrocarbure » que par « hydrocarboné » comme je l’avais traduit dans le précédent message qui a été corrigé.
Dessiner et nommer les hydrocarbures … Dessiner d’abord … Une molécule complexe, occupe de l’espace, et sa géométrie est importante, car ses propriétés mécaniques en dépendent (pensez à la chiralité par exemple). Une notation permet de représenter la géométrie. Les atomes se trouvant sur le plan faisant face à la vue, sont lié par un trait simple, les atomes par devant ce plan, sont liés à ceux du plan par un triangle plein, et les atomes par derrière ce plan, sont liés à ceux du plan, par un trait hachuré. Attention : les représentations omettent parfois la géométrie, et représentent toutes les liaisons sans se soucier de dessiner des triangles pleins ou des traits hachurés ; dans ces cas là, il ne faut pas précipitamment conclure que la molécule est plane ! Les hydrocarbures saturés obéissant tous à la même loi de n’avoir que des relations simples entre les carbones, et que les liaisons restantes soient toutes occupées par des hydrogènes, il suffit de représenter les liaisons entre les carbones. On sait qu’aux vertex on a des carbones, et on sait comment compléter avec les hydrogènes. C’est la représentation la plus simple existante, nommée “skeletal formulae” ou “skeletal representation” en Anglais, et « formule topologique » ou « représentation topologique » en français. Pour le dessins des molécules, vous pouvez aussi voir cette page : How to draw organic molecules (chemguide.co.uk). Nommer … Un partie du préfixe du nom des molécules organiques hydrocarbures, donne le nombre d’atomes de carbone, ainsi :
Quand dans une molécule organique, les carbones ne sont liés que par des liaisons simples, on ajoute du suffixe « ‑ane » au nom de la molécule, par exemple propane, butane, etc. Ces molécules sont aussi indistinctement regroupées sont le nom générique des alcanes. Par exemple le butane est un alcane. Quand dans une molécule organique, il y une ou plusieurs liaison double et aucune liaison triple, on ajoute le suffixe « ‑ène » au nom de la molécule, par exemple le propylène, l’éthylène, etc. Ces molécules peuvent aussi être désignées par le terme générique des alcènes. Par exemple le propylène est un alcène. Les alcanes et les alcènes, sont eux‑mêmes regroupés sous le terme encore plus générique des hydrocarbures, introduit dans le précédent message. Organic chemistry: overview on drawing and naming — AdventuresInSci — 2012 |
|
Administrateur
|
Précédemment, nous avons vu que les molécules organiques les plus simples, sont constituées d’atomes de carbone et d’hydrogène. Si on remplace un ou des atomes d’hydrogène par un groupe d’atome jouant le rôle de l’hydrogène dans la liaison avec le carbone, on obtient des molécules organiques plus complexes, comme les sucres ou les alcools. Ces groupes qui se substituent aux hydrogènes, sont nommés des groupes fonctionnels. Ils semblent être la porte d’entrée dans la chimie organique au sens plus général.
Note : ces groupes peuvent eux‑même contenir du carbone (!), mais ne peuvent évidemment jamais être des hydrocarbures saturés. Les groupes fonctionnels les plus courants sont :
Précédemment, nous avons vu que la formule topologique (skeleton formula) des hydrocarbures, omet de dessiner les hydrogènes et les carbones qui sont implicites. Dans les molécules organiques comprenant des groupes fonctionnels, les groupes fonctionnels, contrairement aux atomes d’hydrogènes, ne peuvent pas si facilement être implicites ; ils sont alors dessinés, et s’ils contiennent des carbones ou des hydrogènes, ces carbones et hydrogènes sont évidemment dessinés, puisqu’ils font parti du groupe fonctionnel. Les règles de nommage que nous avons précédemment vu, sont également complétées pour pouvoir mentionner les groupes fonctionnels. Par exemple un éthane dans lequel un hydrogène est remplacé par le groupe fonctionnel hydroxyle, ne s’appellera plus éthane, mais éthanol ; ou si un hydrogène est remplacé par le groupe fonctionnel amino, la molécule s’appellera éthanamine. La vidéo ne donne pas de liste de ces nouveaux suffixes, alors ce sera pour un autre jour, si encore il existe vraiment une liste. La notation des formules, sans dessin, tient compte aussi des groupes fonctionnels. Par exemple prenons l’éthane, C₂H₆, et remplaçons un de ses hydrogènes, par un groupe fonctionnel hydroxyle, OH, pour obtenir de l’éthanol, sa formule ne sera pas notée C₂H₆O, mais plutôt C₂H₅OH (ou même CH₃‑CH₂‑OH, mais ce sera pour un autre jour). Organic chemistry: overview of functional groups — AdventuresInSci — 2012 À la fin de la vidéo, trois liens sont donnés. Le dernier a disparu, le premier a changé, il est rapporté ici corrigé. |
|
Administrateur
|
Il existe une table périodique des éléments pour la chimie organique. Elle est un sous‑ensemble de la table complète :
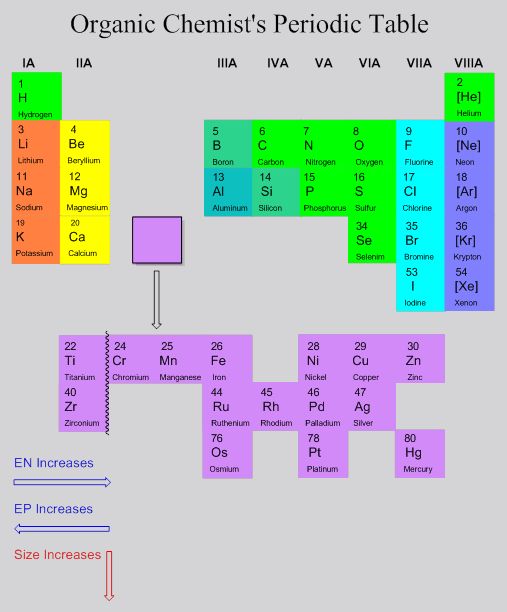 Je ne peux pas donner la source de l’image, le site d’origine semble avoir disparu. N’y faites pas trop attention pour le moment, mais sur l’image, le EN signifie “ electronegativity ” et le EP signifie “ electropositivity ”. Nous verrons plus loin de quoi il s’agit. |
|
Administrateur
|
Précédemment, il était dit que les alcanes et les alcènes sont des termes génériques pour désigner les molécules organiques ne contenant que des liaisons entre carbones, respectivement seulement simples ou parfois doubles, et que les alcanes et alcènes font eux‑même parti des hydrocarbures, un terme encore plus générique.
Une classification plus complète est donnée ici, sous forme graphique, que je rapporte plus bas sous forme texte : Periodic table of elements (coolperiodictable.com) Hydrocarbures — Saturés —— Alcanes — Insaturés —— Alcènes —— Alcynes — Aromatiques —— Arènes Dérivés d’hydrocarbures sans carbonyle — Halides organiques — Alcools — Phénols — Éthers — Amines Dérivés d’hydrocarbures avec carbonyle — Aldéhydes — Cétones — Acides carboxyliques — Esters — Amides |
|
Administrateur
|
En Anglais, le mot « liaison » au sens chimique, se dit “ bond ”. Par exemple on dira “ covalent bond ” pour dire « liaison covalente ».
|
|
Administrateur
|
Utile en chimie organique, une table de classification des éléments, avec l’électronégativité :
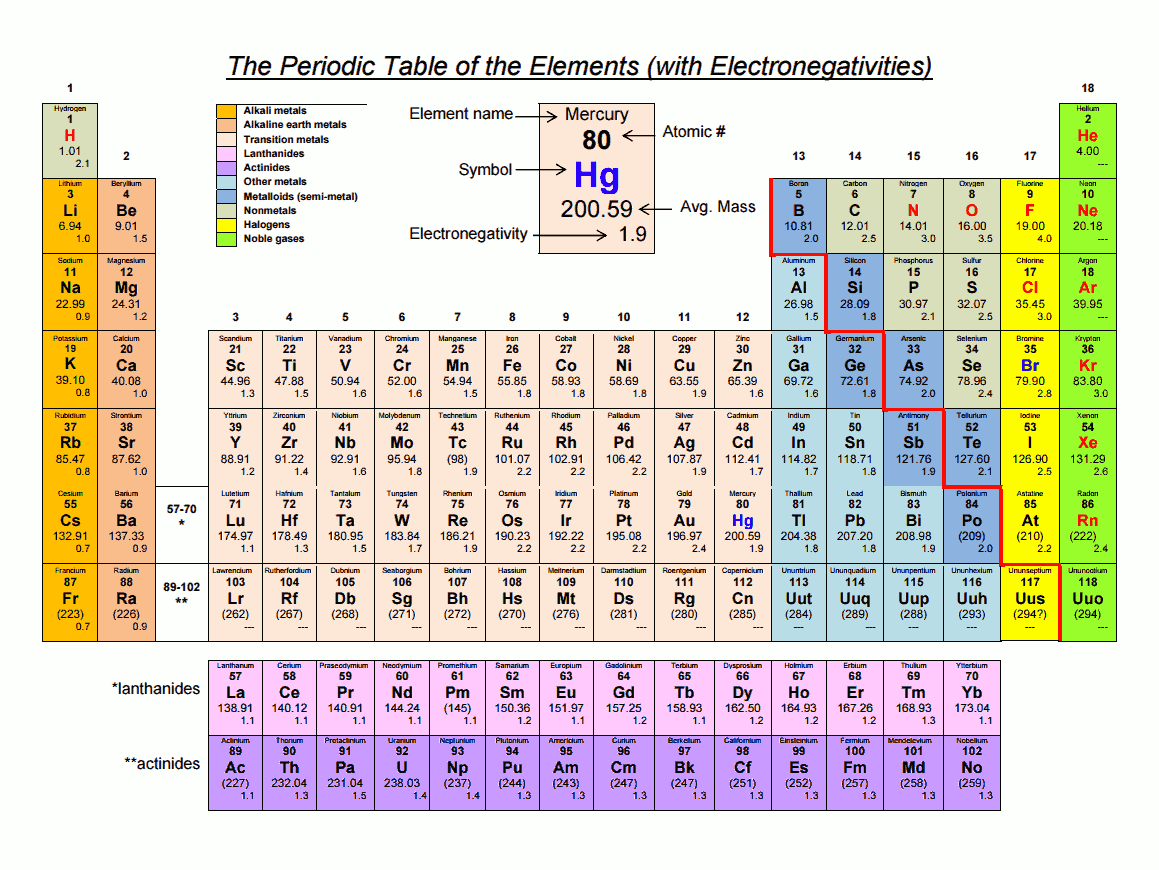 Voir aussi le sujet : Les tableaux de classification des éléments. |
|
Administrateur
|
L’électronégativité d’un atome, est son affinité à attirer les électrons d’un atome auquel il est lié dans une molécule. Plus un atome est électronégatif, plus il attire les électrons. Même si une molécule est électriquement neutre dans son ensemble, les charges électriques peuvent ne pas être réparties uniformément dans la molécule. La probabilité de présence des électrons est plus grande autour des atomes les plus électronégatifs d’une molécule. Mécaniquement, les autres atomes de la molécule auront l’air chargés positivement. N’oubliez pas que la molécule peut être pourtant électriquement neutre dans son ensemble (si la molécule n’est pas ionisée, ce qui est un autre cas). On parle aussi réciproquement, d’électropositivité.
Il ne s’agit de pas charge au sens atomique où un électron est strictement celui d’un atome, c’est plutôt que dans la molécule, un ou des électrons se trouvent plus vers un atome que vers un autre, ils se partagent plus ou moins d’un côté que de l’autre ; on parle de charge partielle. La charge partielle de l’atome vers lequel les électrons vont le plus souvent, peut être représentée par un delta minuscule avec un signe négatif en exposant, δ⁻ , et réciproquement avec un signe positif, pour l’atome que les électrons vont bouder, δ⁺ . Dans le tableau périodique des éléments, sur une même rangé, de gauche à droite, l’électronégativité augmente, et de droite à gauche, l’électropositivité augmente. Par exemple dans le tableau périodique, le carbone et l’oxygène sont sur la même rangé, l’oxygène est plus vers la droite que le carbone, ce qui peut se lire comme « l’oxygène est plus électronégatif que le carbone ». Quand dans une liaison entre deux atomes, un atome est assez plus électronégatif que l’autre, on parle de liaison (covalente) polarisée. Ce qui importe pour savoir si une liaison est polarisée, c’est la différence d’électronégativité entre deux atomes. Cette différence est une valeur. Selon que cette valeur est en dessous ou au dessus de certains seuils, l’appréciation varie. Si la différence est en dessous de 0.5, on considère que la liaison n’est pas polarisée (même si elle l’est légèrement), à partir de 0.5, on considère qu’elle est polarisée, et à partir de 1.7, on considère qu’elle est plus encore, ionisée, un terme plus fort que « polarisée », où on considère que l’un des deux atomes « vole » quasiment des électrons à l’autre.
(*) Ou “ nonpolar bond ” en Anglais. (**) Ou “ polar bond ” en Anglais. Ces seuils sont approximatifs, peuvent un peu varier selon les auteurs. Ceux indiqués plus haut, sont les plus couramment admis. Exemple dans une molécule hydrocarbure, dans la liaison entre deux carbones, l’électronégativité est la même des deux côtés, il n’y aucune polarisation. Exemple dans une molécule hydrocarbure, dans la liaison entre un carbone et un hydrogène : l’électronégativité du carbone est de 2.5, celle de l’hydrogène est de 2.1, la différence entre les deux est de 0.4, elle est supérieure à 0 mais inférieure à 0.5, la liaison est donc considérée comme non‑polarisée. Exemple de la molécule CO (monoxyde de carbone) : l’électronégativité du carbone est de 2.5, celle de l’oxygène est de 3.5, la différence entre les deux est de 1, elle est supérieur à 0.5 est inférieur à 1.7, la liaison est donc considérée comme polarisée, avec un surcroit de charges négatives sur l’oxygène, et réciproquement positive sur le carbone. Exemple de la molécule NaCl (chlorure de sodium, le « sel de table ») : l’électronégativité du sodium est de 0.9, celle du chlore est de 3.0, la différence entre les deux est de 2.1, elle est supérieur à 1.7, la liaison est donc considérée comme ionisée, avec un surcroit de charges négatives sur le chlore qui « vole » les électrons du sodium, et réciproquement négative sur le sodium. Electronegativity and bonding — Khan Academy Organic Chemistry — 2013 Si vous n’avez pas peur d’aller trop loin trop vite, vous pouvez aussi lire ce document, sans vous tracasser sur ce que vous ne comprenez pas : Structure and bonding (chemistry.msu.edu). |
